1 Lembaga Forensik Sains dan Kriminologi Universitas Udayana,
2 Jurusan Farmasi, FMIPA-Universitas Udayana
Abstrak
Toksikologi forensik adalah melakukan analisis kualitatif maupun kuantitatif dari racun dari bukti fisik dan menerjemahkan temuan analisis ke dalam ungkapan apakah ada atau tidaknya racun yang terlibat dalam tindak kriminal, yang dituduhkan, sebagai bukti dalam tindak kriminal (forensik) di pengadilan. Dalam menerjemahankan termuan analisis diperlukan dukungan ilmu farmakokinetik untuk menjawab pertanyaan-pertanyaan, seperti: kapan xenobiotika (obat) tersebut digunakan dan berapa banyak obat tersebut telah dikunsumsi. Melalui pengetahuan biotransformasi akan dimungkinkan untuk merunut balik obat apa (parent drug) yang terlah dikonsumsi. Pengetahuan farmakodinamik dapat membantu dalam menjawab pertanyaan-pertanyaan, seperti: apa efek toksik yang ditimbulkan?, berapa lama efek toksik tersebut berlangsung?. Secara sederhana farmakokinetik menjawab pertanyaan perlakuan apa yang diberikan tubuh pada xenobiotika, sedangkan farmakodinamik menjawab pertanyaan kerja apa yang ditimbulkan oleh xenobiotika terhadap tubuh organisme.
Kata Kunci: toksikologi forensik, farmakokinetik, biotransformasi
* Makalah telah diseminarkan dalam ”Workshop Analisis Toksikologi Forensik” , Badan Pengawas Obat dan Makanan – Jakarta , 7-8 Desember 2005
Alamat Pengarang: Jurusan Farmasi – FMIPA – Universitas Udayana, Gedung AF – Lingkungan FAPET – Kampus Bukit – Jimbaran, Email: mgelgel1@yahoo.de
1.) Pendahuluan
Analisis toksikologi adalah gabungan antara kimia analisis dan ilmu toksikologi. Dalam prakteknya dan mengacu pada target analisis, maka analisis toksikologi dapat bermuara pada dua bidang, yaitu analisis toksikologi forensik dan analisis toksikologi klinik.
Kerja utama dari toksikologi forensik adalah melakukan analisis kualitatif maupun kuantitatif dari racun dari bukti fisik dan menerjemahkan temuan analisisnya ke dalam ungkapan apakah ada atau tidaknya racun yang terlibat dalam tindak kriminal, yang dituduhkan, sebagai bukti dalam tindak kriminal (forensik) di pengadilan. Hasil analisis dan interpretasi temuan analisisnya ini akan dimuat ke dalam suatu laporan yang sesuai dengan hukum dan perundangan-undangan.
Analisis toksikologi klinik adalah analisis kualitatif dan kuantitatif dari suatu toksikan pada kasus keracunan, yang bertujuan untuk memastikan diagnose klinis, dimana diagnose ini dapat dijadikan dasar dalam melakukan terapi yang cepat dan tepat, serta lebih terarah, sehingga ancaman kegagalan pengobatan (kematian) dapat dihindarkan. Dari hasil analisis kualitatif dapat dipastikan bahwa kasus keracunan adalah memang benar diakibatkan oleh instoksikasi. Sedangkan dari hasil analisis kuantitatif dapat diperoleh informasi tingkat toksisitas pasien. Dalam hal ini diperlukan interpretasi konsentrasi toksikan, baik di darah maupun di urin, yang lebih seksama. Untuk mengetahui tepatnya tingkat toksisitas pasien, biasanya diperlukan analisis toksikan yang berulang baik dari darah maupun urin. Dari perubahan konsentrasi di darah akan diperoleh gambaran apakah toksisitas pada fase eksposisi atau sudah dalam fase eleminiasi.
Tubuh mengenal drug sebagai senyawa asing atau xenobiotika. Jika tubuh terpejan oleh xenobiotika, maka tubuh akan berusaha menghancurkan dan kemudian mengeliminasi senyawa xenobiotika ini dari dalam tubuh.
Ilmu farmakologi mencangkup ilmu farmakodinamik dan farmakokinetik, sedangkan ilmu biotransformasi juga dibahas dalam ilmu farmakokinetik. Farmakodinamik adalah bidang ilmu yang menelaah interaksi xenobiotika dengan reseptor serta mengamati efek (perubahan baik mental maupun fisik) yang ditimbulkan pada individu diakibatkan interaksi tersebut. Sedangkan farmakokinetik mempelajari kinetika absorpsi, distribusi dan eliminasi (ekskresi dan metabolisme) dari xenobiotika. Uraian distribusi dan eleminasi xenobiotika sering diistilahkan sebagai disposisi xenobiotika. Farmakokinetik dapat juga dipandang suatu bidang ilmu, yang mengkaji perubahan konsentrasi (kinetika) dari xenobiotika di dalam tubuh organisme sebagai fungsi waktu. Perubahan konsentrasi xenobiotika ditentukan oleh: dimana dan berapa cepat xenobiotika diabsorpsi menuju ke sirkulasi sistemik, bagaimana terdistribusi di dalam tubuh organisme, bagaimana enzim tubuh merubah struktur molekulnya, serta dari mana dan berapa cepat dieksresi dari dalam tubuh (Mutschler dan Schäfer-Korting, 1997).
Dalam tulisan ini akan lebih ditekankan pada pembahasan bagaimana peran bidang ilmu, farmakokinetik, serta biotransformasi) dalam pengelenggaraan tugas toksikologi forensik atau toksikologi klinik.
2.) Proses Farmakokinetik
Farmakokinetik melibatkan proses invasi (masuknya xenobiotika ke tubuh), trasportasi dan distribusi (pergerakan xenobiotika di dalam tubuh), serta proses eleminasi (proses hilangnya xenobiotika dari dalam tubuh). Proses ini semua menentukan efficacy (kemampuan xenobiotika mengasilkan efek), efektifitas dari xenobiotika, konsentrasi xenobiotika di reseptor, dan durasi dari efek farmakodinamiknya.
2.1. Proses invasi
Proses invasi disebut juga dengan absorpsi, yang ditandai oleh masuknya xenobiotika dari tempat kontak (paparan) menuju sirkulasi sistemik tubuh. Laju absorpsi xenobiotika ditentukan oleh sifat membran biologis dan aliran kapiler darah tempat kontak serta sifat fisiko kimia dari xenobiotika itu sendiri. Pada pemakaian oral (misal sediaan dalam bentuk padat), maka terlebih dahulu kapsul/tablet akan terdistegrasi, sehingga xenobiotika akan telarut di dalam cairan saluran pencernaan. Xenobiotika yang terlarut ini akan terabsorpsi secara normal dalam duodenal dari usus halus dan ditraspor melalui pembuluh kapiler mesenterika menuju vena porta hepatika menuju hati sebelum ke sirkulasi sistemik.
Tabel 1. Beberapa contoh rute pemakaian obat-obat terlarang
| Rute | Drugs (Obat-Obat terlarang) |
| Oral | cannabinoide, opiate, LSD, meskalin, benzodiazepin, barbiturate, anti depresan tri-siklik, ecstasy |
| Inhalasi | pelarut-pelarut perangsang (terpentin, kloroform, eter, dll), alkaloid dengan titik didih yang rendah (nikotin, kokain, amfetamin) |
| Merokok | marijuana, daun ganja, Crack ”kokain”, metamfetamin, |
| Intravenus | heroin, morfin, kokain, metamfetamin, fensilidin |
| Intranasal | kokain, heroin, methamfetamin |
| Dermal | fentanyl, nikotin. |
Paparan xenobiotika (rute administrasi) dapat melalui oral, inhalasi, topikal, rektal, atau vaginal. Sedangkan pemasukan xenobiotika langsung ke sirkulasi sistemik (injeksi), dapat dikatakan bahwa xenobiotika tidak mengalami proses absorpsi. Rute pemakaian obat akan mempengaruhi onset dari aksi, durasi efek, intensitas dan qualitas efek dari obat. Pada pemakaian intravenus obat dapat langsung ditranspor ke reseptor, rute pemakaian ini tentunya akan memberikan efek yang paling maksimum dan onset aksi yang singkat. Namun pemakaian intravenus pada penyalahgunaan obat terlarang lebih banyak menimbulkan resiko yang berbahanya, oleh sebab itu pada kasus ini pemakaian melalui inhalasi dan merokok merupakan alternatif yang lebih poluler dikalangan junkies. Jika drug dihisap melalui hidung atau bersamaan dengan rokok, maka drug akan sangat cepat terabsorpsi di alveoli paru-paru, dan selanjutnya melalui pembuluh darah arteri dibawa ke otak. Oleh sebab itu efek akan lebih cepat timbul. Pemakaian ”crack” (bentuk kokain yang digunakan secara merokok) dengan menghisap akan menimbulkan onset aksi yang sangat singkat, sehingga intesitas eforia akan cepat tercapai. Demikian juga pada pemakain heroin secara inhalasi, efek eforia akan relatif sama tercapainya dibandingkan dengan pemakaian secara intravenus.
Heroin biasanya digunakan dengan cara menguapkan dan kemudian uap dihirup, dengan merokok, atau injeksi secara intravenus. Setelah heroin sampai di sirkulasi sistemik, maka heroin sangat cepat menuju otak. Karena sangat cepatnya timbulnya efek pada pemakaian intravenus, maka rute pemakaian ini sangat digemari oleh para junkis. Namun pemakain ini sangat berresiko ketimbang pemakaian secara inhalasi atau merokok, karena sering ditemui muncul penyakit bawaan lain pada pemakaian injeksi, seperti infeksi HIV, hepatitis.
2.2. Tansport dan Distribusi
Setelah xenobiotika berada di pembuluh darah, maka bersama-sama darah melalui sirkulasi sistemik akan ditranspor ke seluruh tubuh, selanjutnya dari sirkulasi sistemik akan terdistribusi ke berbagai organ dan jaringan.
Transport dapat di kelompokkan ke dalam dua proses utama, yaitu konveksi (transport xenobiotika bersama aliran darah) dan difusi (transport xenobiotika melalui membran biologis). Sirkulasi sistemik sangat memegang peranan penting dalam transport xenobiotika antar organ dan jaringan di dalam tubuh. Sehingga laju peredaran darah di dalam organ atau jaringan juga akan menentukan kecepatan distribusi xenobiotika di dalam tubuh.
Difusi xenobiotika melalui membran biologis dapat berlangsung melalui berbagai proses, seperti: difusi pasiv, difusi aktiv, melalui poren dan juga melalui jembatan intraseluler.
Ketika xenobiotika mencapai pembuluh darah, maka bersama darah melalui sirkulasi sistemik siap untuk didistribusikan ke reseptor dan ke seluruh tubuh. Untuk memudahkan memahami sejauh mana suatu xenobiotika terdistribusi di dalam tubuh, para ilmuan farmakokinetik mengumpamakan bahwa xenobitika di dalam tubuh akan terdistribusi di dalam suatu ruang, yang memiliki sejumlah volume tertentu. Jadi kemampuan suatu xenobiotika untuk terdistribusi di dalam tubuh dinyatakan sebagai parameter yang disebut dengan volume distribusi.
Terdapat banyak faktor yang dapat mempengaruhi proses distribusi dari suatu xenobiotika, dimana faktor-faktor tersebut dapat dikelompokkan menjadi dua, yaitu: a) faktor biologis: laju aliran darah dari organ dan jaringan, sifat membran biologis, dan perbedaan pH antara plasma dan jaringan; b) faktor sifat molekul xenobiotika: ukuran molekul, ikatan antara protein plasma dan protein jaringan, kelarutan, dan sifat kimia.
Senyawa yang larut lemak akan lebih mudah terdistribusi ke seluruh jaringan tubuh, sehingga pada umumnya senyawa lipofil akan mempunyai volume distribusi yang jauh lebih besar ketimbang senyawa yang hidrofil. Tetra-Hidro-Canabinol (THC) (zat halusinogen dari tanaman ganja) adalah sangat larut lemak, sehingga THC akan sangat mudah terdistribusi ke seluruh jaringan dan akan terdeposisi di jaringan lemak, oleh sebab itu THC memiliki volume distribusi yang relatif besar (4-14 l/kg). Karena kelarutannya yang tinggi, hal itu pun menyebabkan THC sangat lama tertambat di jaringan lemak, dan ini akan memperlambat laju eliminasi THC. Etanol (alkohol), senyawa yang bersifat agak hidrofil, sebagian besar terdistribusi di dalam cairan intra- dan ekstraseluler tubuh. Volume distribusi (Vd) etanol adalah 0,5 l/kg.
2.3. Eliminasi
Yang dimaksud proses eliminasi adalah proses hilangnya xenobiotika dari dalam tubuh organisme. Eliminasi suatu xenobiotika dapat melalui reaksi biotransformasi (metabolisme) atau ekskresi xenobiotika melalui ginjal, empedu, saluran pencernaan, dan jalur eksresi lainnya (kelenjar keringan, kelenjar mamai, kelenjar ludah, paru-paru). Jalur eliminasi yang paling penting adalah eliminasi melalui hati (reaksi metabolisme) dan eksresi melalui ginjal.
Ginjal sangat memegang peranan penting dalam mengekskresi baik senyawa eksogen (xenobiotika) maupun seyawa endogen, yang pada umumnya tidak diperlukan lagi oleh tubuh. Proses utama ekskresi renal dari xenobiotika adalah: filtrasi glumerula, sekresi aktiv tubular, dan resorpsi pasiv tubular. Pada filtrasi glumerular, ukuran melekul memegang peranan penting. Resorpsi pasiv tubular ditentukan oleh gradien konsentrasi xenobitika antara urin dan plasma di dalam pembuluh tubuli. Berbeda dengan resorpsi tubular, sekresi tubular melibatkan proses transport aktiv.
Xenobiotika yang masuk ke dalam tubuh akan diperlakukan oleh sistem enzim tubuh, sehingga senyawa tersebut akan mengalami perubahan struktur kimia dan pada akhirnya dapat dieksresi dari dalam tubuh. Proses biokimia ini dikenal dengan reaksi biotransformasi. Biotransformasi pada umumnya berlangsung di hati dan sebagian kecil di organ-organ lain seperti: ginjal, paru-paru, saluran pencernaan, kelenjar susu, otot, kulit atau di darah.
Biotransformasi belangsung dalam dua tahap, yaitu reaksi fase I dan fase II. Rekasi fase I melibatkan reaksi oksidasi, reduksi dan hidrolisis. Sedangkan reaksi fase II adalah pengkopelan hasil reaksi fase I (metabolit fase I) dengan suatu senyawa endogen. Reaksi fase II disebut juga reaksi konjugasi.
3.) Pemodelan Farmakokinetik
Dalam mempelajari farmakokinetik suatu xenobiotika haruslah disadari, bahwa semua proses farmakokinetik terjadi tidaklah seperti alur blok yang diskret (satu proses akan diikuti oleh proses yang lain apabila proses sebelumnya telah tuntas berakhir), melainkan lebih merupakan suatu proses kombinasi satu dengan yang lain. Setelah molekul xenobiotika diabsorpsi dan menuju sirkulasi sistemik, maka akan siap di transportasi ke seluruh tubuh, dalam waktu bersamaan akan ada molekul xenobiotika yang berikatan dengan reseptor dan ada terdapat juga molekul yang lain mengalami reaksi metabolisme, atau ada molekul yang langsung dieksresi oleh ginjal. Proses ini yang dimaksud dengan kombinasi satu dengan yang lain.
Kompartemen model adalah pemodelan klasik, yang sampai saat ini masih banyak digunakan, yang digunakan untuk menggambarkan sifat disposisi (perubahan konsentrasi sebagai fungsi waktu) xenobiotika di dalam tubuh. Kompartemen model adalah gambaran kinetik, yang mengkarakterisasi sifat-sifat absorpsi, disposisi, dan eliminasi dari suatu xenobiotika di dalam tubuh. Karena kompartemen merupakan gambaran sifat kinetik, maka seharusnya pengertian suatu kompartemen dilandasi (dibatasi) atas laju dari suatu proses. Oleh sebab itu kompartemen disini tidak dapat didefinisikan sebagai suatu ruang, melainkan suatu poses yang memiliki laju yang sama (Weis 1990).
Kurva konsentrasi suatu xenobiotika di dalam cairan tubuh merupakan jumlah dari proses invasi, distribusi, dan eliminasi. Proses invasi digambarkan sebagai fungsi input „I(t)“ dan proses ini menggambarkan bagaimana suatu xenobiotika mencapai sirkulasi sistemik. Poses distribusi dan eliminasi dirangkum ke dalam fungsi disposis“fd(t)“. Sehingga kurva-konsentrasi-waktu (konsentrasi profil) suatu xenobiotika merupakan gabungan dari fungsi input dan disposisi dari xenobiotika tersebut. Persamaan matematis dari fungsi ini dapat ditulis dengan menggunakan operasi konvulasi. Operasi ini ditandai dengan asterik (*), sehingga konsentrsi profil suatu xenobiotika dapat ditulis sebagai:
C (t) = I (t) * fd (t) (1)
Perubahan konsentrsi dari sebagaian besar xenobiotika di dalam tubuh, mengikuti hukum kinetika orde ke pertama, hanya sedikit xenobiotika mengikuti orde ke nol. Alkohol adalah salah satu xenobiotika yang perubahan konsentrasinya di dalam tubuh manusia mengikuti hukum kinetika orde ke nol, yang artinya alkohol dieliminasi dari tubuh dengan kecepatan yang konstan.
Laju invasi dan disposisi mengikuti hukum kinetika orde ke pertama artinya laju invasi dan disposisi berbanding lurus dengan konsentrasi xenobiotika. Secara umum fungsi diposisi ini digambarkan sebagai jumlah fungsi eksponential:
 (2)
(2)
ai dan li = parameter diposisi
n = jumlah fungsi eksponensial (jumlah dari kompartemen)
t = waktu
Jika suatu xenobiotika diberikan secara intravenus dan perubahan konsentrasinya mengikuti hukum kinetika orde ke pertama, maka fungsi profil konsetrasinya dapat dinyatakan sebagai berikut:
 (3)
(3)
Div = adalah sama dengan fungsi input I(t)
Target analisis toksikologi tidaklah hanya senyawa induk, melainkan juga metabolitnya. Memperhatikan hubungan konsentrasi senyawa induk dan metabolit pada setiap waktu dapat menggambarkan keseluruhan jaringan proses farmakokinetik. Konstelasi konsentrasi antara senyawa induk dan metabolitnya sebagai fungsi waktu merupakan hal yang penting bagi toksikolog forensik dalam menginterpretasikan hasil analisis berkaitan dengan pertanyaan kapan suatu paparan itu terjadi. Oleh sebab itu disini dipandang perlu untuk menjelaskan model metabolit kinetik.
Dalam menganalisis metabolit kinetik digunakan istilah senyawa induk (p) dan juga metabolit primer (mi). Metabolit kinetik adalah analisa matematis dari profil konsentrasi senyawa induk dan metabolit yang terbentuk. Sampai saat ini terdapat beberapa model untuk menganalisa metabolit kenetik dari suatu xenobiotika, yaitu: model kompartemen klasik, model psiologi, dan model komparten terbuka (Wirasuta, 2004).
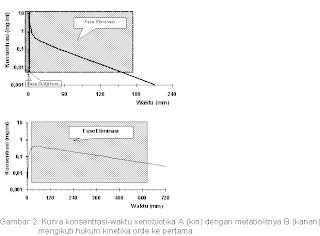
Penjelasan Gambar 2: A setelah intravenus, profil konsentrasinya mengikuti model disposisi dua-kompartemen, dimana setelah injeksi A sangat cepat terdistribusi (fase distribusi), yang ditandai dengan penurunan konsentrasi yang sangat cepat, kemudian diikuti dengan fase elminasi, pada saat ini terjadi kesetimbangan kecepatan trasport antara kedua kompartemen. Waktu paruh (t½) fase eliminasi biasanya digunakan oleh toksikolog forensik untuk menghitung/meraka kapan xenobiotika ”drug” pada waktu awal ”initial time” pemakaian.
Banyak xenobiotika di dalam tubuh tidak mengikuti model satu kompartemen, sehingga dalam melakukan analisis matematik metabolit kinetik xenobiotika seperti ini akan sangat komplek. Masalah ini akan lebih mudah dipecahkan apabila analisa matematisnya dengan menggunakan model kompartimen terbuka, dimana persamaan matematis diselesaikan dengan menggunakan Transformasi Laplace (Weiss 1998, Wirasuta 2004). Konsep dari model ini didasarkan pada asumsi bahwa perubahan konsentrasi xenobiotika dan metabolitnya di dalam tubuh mengikuti hukum kinetik orde pertama, sehingga profil konsentrasi suatu xenobiotika dapat digambarkan sebagai jumlah persamaan eksponential. Jika xenobiotika (senyawa induk „p“ diberikan secara intravenus maka profil konsentrasinya seperti yang tertulis dalam persamaan (3). Tranformasi persamaan tersebut ke daerah Laplace memberikan persamaan berikut ini:
 (4)
(4)
Reaksi biokimia pembentukan metabolit primer dan transpor metabolit yang terbentuk dari tempat reaksi metabolisme ke sirkulasi sistemik membutuhkan waktu. Laju rekasi dan tranpor ini dikenal dengan fungsi waktu-transit-metabolisme „„Ψp_m (t)“ (Weiss 1998). Jika metabolisme berlangsung di hati, maka fungsi ini dikenal dengan fungsi waktu-transit-metabolisme-hepatika, fungsi ini ditulis sebagai:
 (5)
(5)
p_m = konstanta waktu dari fungsi-waktu-transit-metabolisme
Fungsi input dari biosintesa metabolit primer „Im(s)“ adalah:
 (Weiss 1998) (6)
(Weiss 1998) (6)
Fp_m = Fraksi dari senyawa induk „p“ yang terbentuk menjadi metabolit primer
CLp = Clearance senyawa induk
Ψp_m (s) = Fungsi waktu-transit-metabolisme dari senyawa induk membentuk metabolit primer
Menurut persamaan (1), maka profil konsentrasi metabolit primer adalah:
 (7)
(7)
 (8)
(8)
Parameter Farmakokinetik
Clearance (CL) adalah satuan kemampuan dari organisme (organ tubuh) untuk mengeliminasi suatu xenobiotika. Clearence dapat juga dimengerti dengan jumlah volume dari xenobiotika yang mampu dieliminasi oleh organ (organismus) persatuan waktu. Oleh sebab itu satuan clearance adalah volume perwaktu (misal, ml/min).
Waktu paruh (t1/2) adalah waktu yang dibutuhkan oleh xenobiotika tereliminasi menjadi setengah konsentrasi awalnya. Waktu paruh pada fase akhir disposisi (fase eliminasi) dikenal sebagai waktu paruh terminal (t1/2 Z). Hurup z menandakan fase akhir disposisi. Fase ini biasanya ditunjukkan oleh proses farmakokintik yang paling lambat. Waktu paruh dari metabolit yang diperoleh dari penghitungan secara logaritma kurva-konsentrasi-waktu metabolit dari senyawa induk biasanya disebut dengan waktu paruh semu ”apparance half life time” (t1/2 app). Waktu paruh setiap fase disposisi, dimana laju eliminasinya memenuhi hukum kinetika orde pertama.
Volume distribusi (Vd) adalah volume virtual, dimana kelihatannya suatu xenobiotika terdistribusi atau di mana dianggap xenobiotika tersebut terlarut. Volume distribusi menyatakan suatu faktor yang harus diperhitungkan dalam memperkirakan jumlah xenobiotika dalam tubuh dari konsentrasi xenobiotika yang ditemukan dalam kompartimen cuplikan.
Untuk sebagaian besar xenobiotika dianggap bahwa xenobiotika bersetimbangan secara cepat dalam tubuh. Tiap jaringan dapat mengandung suatu konsentrasi xenobiotika yang berbeda sehubungan dengan perbedaan afinitas xenobiotika terhadap jaringan tersebut. Oleh karena itu volume distribusi tidak mengandung suatu arti fiosologik yang sebenarnya.
Dalam kinetika kompartemen ganda kita dapat menganggap secara matematik volume hipotetik, seperti volume dari kompartimen sentral (Vc) dan volume kompartemen perifer atau kompartemen jaringan (Vp). Volume distribusi, yang dihitung pada keadaan tunak ”steady state”, dimana laju obat masuk dan keluar dari dan ke kompartemen perifer adalah sama, disebut dengan volume distribusi dalam keadaan tunak.
Oleh karena clearance total sama dengan dosis/AUC tot, maka Vß dapat dinyatakan dalam clearance dengan tetapan laju eliminasi pada fase terminal (λz). Volume distribusi area dipengaruhi oleh laju eliminasi obat pada fase terminal dan clearance total obat dari dalam tubuh. Perubahan ini mungkin diakibat oleh perubahan fungsi organ tubuh (ginjal, hati). Sedangkan volume distribusi pada keadaan tunak tidak dipengaruhi perubahan eliminasi obat.
4.) Peran toksokinetik dalam analisis toksikologi
Seperti yang telah bahasan di atas, toksokinetik melibatkan proses absorpsi, distribusi, dan eliminasi (metaboliesme dan eksresi) dari xenobiotika di dalam tubuh. Untuk mendekatkan pemahaman peran toksokinetik dalam tosikologi forensik, pada bahasan ini akan dicoba mengulas sifat toksokinetik opiat (heroin dan asetilkodein) pada penyalahgunaan heroin illegal. Heroin ilegal diperoleh dengan memasak opium dengan asam asetat anhidrat. Morfin akan diasetilasi menjadi heroin, asetilasi kodein akan membentuk asetilkodein.
4.1. Merunut balik senyawa induk yang dikonsumsi
Menurut Undang-Undang (UU) no 22 tahun 1997 tentang narkotika (pasal 84 dan 85), tercantum konsekuensi hukuman yang berbeda bagi pengguna Narkotika (Golongan I, II dan II) secara ilegal. Bagi pengguna terhadap orang lain (pasal 84) dapat di kenakan hukuman penjaara paling lama dari 5 sampai 15 tahun, atau dengan denda uang berkisar antara 250 juta rupiah sampai 750 juta rupiah. Menggunakan Narkotika secara ilegal bagi diri sendiri dapat dikenakan hukuman penjara paling lama dari 1 sampai 4 tahun (pasal 85).
Berdasarkan jalur metabolisme heroin dan asetil kodein (gambar 3), terlihat bahwa, kodein (narkotika golongan III) akan termetabolisme membentuk morfin (narkotika golongan II). Demikian juga apabila seseorang telah mengkonsumsi heroin ilegal pada waktu tertentu mungkin untuk mendeteksi kombinasi yang hampir sama pada penggunaan kodein. Sedangkan menurut UU no 22 tentang Narkotika, penyalahgunaan narkotika golongan I, II, dan III mempunyai konsekuensi hukum yang berbeda. Oleh karena itu interpretasi temuan analisis pada penyalahgunaan narkotika, khususnya merunut balik sumber narkotika yang telah dikonsumsi adalah mutlak.
Sifat toksokinetik opiat
Melalui reaksi enzimatis deasetilasi dan hidrolisis, hampir 98% dari dosis heroin akan terdeasetilasi membentuk 6- asetil morfin (6-AM) dan kemudian menjadi morfin. Enzim yang terlibat dalam reaksi deasetilasi ini dalam deasetilasi heroin adalah serumbutiril-kolinesterase (BuChE) dan eritrocitasetil-kolinesterase (AChE) (LOCKRIDGE et al. 1980, SALMON et al. 1999), namun pada deasetilasi 6-AM menjadu morfin hanya enzim AChE yang terlibat (Salmon et al., 1999). Morfin hampir sekitas 60 % melalui enzim Uridin-difosfat-glukuronosilstransferase (UGT) terglukuronidasi membentuk morfin-3-glukuronida (M3G), dan sekitar 10% membentuk morfin-6-glukuronida (M6G) (YEH et al. 1977, OSBORNE et al. 1990). Morfin hanya dalam jumlah yang sangat sedikit melalui enzim sulfotransferasi membentuk morfin-3-sulfat dan demikian juga melalui enzim okasidasi N-demetilasi membentuk normorfin (Yeh et. al. 1977). Selanjutnya normofin terkunjugasi dengan asam glukuronat membentik normorfin-6-glukuronida.

Waktu paruh heroin berkisar antara 1,3 sampai 10 menit (Inturrisi et al. 1984, Cone et al. 1993, Gyr et al. 2000, Rentsch et al. 2001). Waktu paruh semu dari 6-MAM setelah pemakaian heroin berkisar antara 10 sampai 52 menit (Cone et al. 1993, Bourquin et al. 1999, Gyr et al. 2000).
Setelah pemakaian intravenus konsentrasi puncak dari 6-AM tercapai sekitar 1,5 sampai 6 menit setelah injeksi (Bourquin et al. 1999, Gyr et al. 2000, Rentsch et al. 2001). Pada intravenus 200 mg heroin pada sekelompok pecandu, setelah 60 sampai 125 menit setelah pemakaian 6-MAM masih dapat dideteksi di darah. Batas deteksinya adalah 10 ng/ml.
Dalam selang waktu 24 jam setelah injeksi intravenus heroin, maka di urin sekitar 2% dari dosis akan tereksresi sebagai 6-AM, antara 3-8% dalam bentuk morfin, dan 42-60% dalam bentuk morfinglukuronida (Yeh et al. 1976, Cone et al. 1991).
Asetil kodein di dalam tubuh akan terhidrolisis membentuk kodein. Waktu paruh semu “apparance half life” adalah sekitar 42 menit (Wirasuta, 2004). Selanjutnya dari kodein sebagian besar termetabolisme membentuk kodein-6-glukuronid (K6G). Kodein juga dimetabolisme melalui N-demithilasi membentuk morfin. Okasidasi kodeina akan terbentuk norkodein.
Dalam kurun waktu 24 jam setelah injeksi asetil kodein di urin akan diketemukan sekitar 0,15 - 5,5 % asetil kodein, 5-24% kodein (Staub et al. 2001, Brenneisen et al. 2002). Sedangkan pada pemakaian kodein, dalam kurun waktu 48 jam di urin kemungkinan diketemukan sekiatar 3 - 16,6% kodein, 40 - 95% Kodein-6-glukuronida, sekitar 0 - 12% total morfin (morfin bebas dan morfin glukuronida), dan sekitar 0,7-7,2 % Norkodein (Vree dan Verwey-Van Wissen 1992, Chen et al. 1991, Caraco et al. 1999). Variasi jumlah morfin yang diekstrsi di urin setelah pemakaian kodein ditentukan oleh faktor genetika.
Hambatan dalam merunut balik sumber opiat yang telah dikonsumsi
Sifat toksokinetik (farmakokinetik dan metabolisme) opiat dapat dijadikan landasan untuk menduga kemungkinan mendeteksi opiat baik di dalam spesimen biologis (darah atau urin) pada waktu tertentu setelah pemakaian serta hambatan-hambatan yang mungkin muncul dalam merunut sumber opiat yang telah dikunsumsi (Wirasuta, et al 2002, 2003, 2005). Tabel 2 menggambarkan kemungkinan-kemungkianan senyawa opiat yang dapat dideteksi di darah atau urin berdasarkan alur metabolismenya (lihat gambar 3).
Tabel 2: Senyawa-senyawa yang mungkin dideteksi di darah atau urin apabila mengkonsumsi produk tertentu dari opiat
| Opiat Konsumsi | Heroin | 6-AM | Morfin | MG | Acetilkodein | Kodein | KG |
| Opium | | | + | + | | + | + |
| “Heroin-ilegal” | + | + | + | + | + | + | + |
| Morfin | | | + | + | | | |
| Kodein | | | + | + | | + | + |
6-AM: 6-Acetilmorfina, MG: Morfin-glukuronid; KG: Kodein-glucuronid. Di dalam opium terkandung sekitar 8-14% morpfin, 0,5-3% kodein dan alkaloid lainnya. “Heroin-ilegal” biasanya mengandung acetilkodein sebagai pengotor akibat proses produksi.
Waktu paruh dari opiat sangat bervariasi (lihat gambar 3), akan ikut juga memberi andil kesulitan dalam menduga (menginterpretasikan) temuan analisis. Variasi waktu paruh ini dan perbedaan rentang waktu antara saat mengkonsumsi opiat dan pengambilan sampel berperan sangat penting dalam menemukan kemungkinan-kemungkinan kombinasi pada deteksi opiat di darah maupun di urin (Wirasuta 2005).
Karena waktu paruh heroin yang sangat cepat, pada prakteknya (baik pada kasus kematian karena keracuanan heroin maupun kasus forensik lainnya) sangat tidak mungkin mendeteksi heroin di sampel darah maupun urin. Demikian halnya dengan 6-AM, akan relativ cepat (t½ = 10-50 menit) terhidrolisis menjadi morfin. Dari 699 kasus positiv opiat, hanya 3,5%-nya di darah positiv mengandung 6-AM (Wirasuta et al. 2002). Apabila seseorang telah mengkonsumsi “heroin-ilegal”, pada fase awal eliminasi adalah mungkin untuk mendeteksi kombinasi dari 6-AM, morfin, kodein, morfin-glukoronid dan kodein-glukoronid. Apabila retang waktu antara saat mengkonsumsi “heroin-ilegal” dan pengambilan sampel relativ luas, maka di darah hanya mungkin menemukan morfin- dan kodein-glukuronida.
Kodein melalui O-demethilasi akan membentuk morfin. O-demethilasi dari kodein dipengaruhi oleh faktor genetik. Hal ini berpengaruh pada jumlah fraksi morfin yang akan terbentuk dari kodein. Laju O-demethilasi kodein juga berpengaruh pada waktu paruh morfin. Faktor-faktor ini juga menentukan munculnya kombinasi kualitatif opiat setelah mengkonsumsi kodein. Sehingga dimungkinkan untuk memperoleh kombinasi kualitatif yang sama dari opiat, apabila seseorang telah mengkonsumsi “heroin-ilegal” atau kodein (Wirasuta 2005).
Pada akhirnya dapat disimpulkan beberapa faktor yang menghambat dalam merunut balik sumber opiat (heroin atau kodein) yang telah disalahgunakan, yaitu: heroin illegal mengandung asetil kodein atau mungkin kodein, opium mengandung morfin dan kodein, sebagaian kodein dimetabolisme menjadi morfin, pada O-demetilasi kodein menjadi morfin sangat ditentukan oleh faktor genetik, yang berakibat pada perbedaan fraksi terbentuknya morfin dari kodein, atau laju eliminasi kodein dan morfin adalam berbeda.
Metode merunut balik (pembedaan antara konsumsi heroin illegal dan kodein)
Secara praktis mendeteksi 6-AM atau asetil kodein baik di darah maupun di urin sudah dapat dijadikan bukti bahwa seseorang telah mengkonsumsi heroin. Namun karena laju elminasi dari 6-AM dan asetil kodein yang relativ cepat sehingga dalam prakteknya kedua opiat ini sangat jarang dideteksi pada kasus penyalahgunaan heroin illegal (O’neal dan Polkis 1998, Bogusz et al. 2001, Wirasuta 2004), sehingga metode ini sangat kurang relevan.
Karena perbedaan laju elminasi morfin dan kodein, maka peneliti mengusulkan ratio konsentrasi antara kodein dan morfin ([COD]/[M]) baik di darah maupun di urin sebagai parameter untuk membedakan apakah seseorang telah mengkonsumsi heroin illegal atau kodein (Sticht et al. 1985, Schmitt et al. 1990, Ceder dan Jones 2001). Karena metode yang telah ada masih terdapat kelemahan, dimana belum memberikan hasil yang sensitif.
Oleh karena itu, berdasarkan sifat farmakokinetik baik dari heroin dan metabolitnya maupun asetil kodein dan metabolitnya, Wirasuta (2002) telah mensimulasikan baik kombinasi kualitatif opiat maupun laju perubahan ratio [COD]/[M] dan ratio antara kodein glukuronid dan morfin glukuronid ([CG]/[MG]) apabila seseorang mengkunsumsi intravenus heroin ilegal atau oral kodein. Hasil simulasinya menunjukkan bahwa:
- ada kombinasi kualitatif yang berbeda antara mengkunsumsi intravenus heroin ilegal dan oral kodein (tabel 3),
- terdapat perbedaan arah perkembangan kurva ratio konsentrasi baik [COD]/[M] maupun [CG]/[MG] (gambar 4), dimana pada fase eliminasi terminal dimungkinkan menemukan harga ratio konsentrasi [COD]/[M] yang sama. Setelah intravenos heroin ilegal terjadi peningkatan nilai ratio konsentrasi, sedangkan hal yang sebaliknya diperoleh pada pemakaian oral kodein. Dari data simulasi diperoleh harga ratio [CG]/[MG] yang selalu berbeda pada kedua pemakaian opiat, dimana pada intravenus heroin ilegal ratio konstrasi ini selalu berada dibawah 1 (satu), sedangkan pada pemakaian oral kodein harga ratio ini selalu lebih besar dari 1 (satu).
Dari hasil di atas dapat disimpulkan bahwa, adalah mungkin membedakan antara pemakaian heroin ilegal dengan oral kodein berdasarkan kombinasi kualitatif hasil analisis opiat. Pemisahan yang semakin selektif akan diperoleh apabila memperhatikan tingkat ratio konsentrasi [CG]/[M].
Tabel 3: Munculnya kombinasi kualitatif dari hasil analisis opiate di darah setelah mengkonsumsi heroin ilegal atau oral kodein (Wirasuta 2004)
| fase terminal | | g COD |
| g M | | |
| | (f+g) COD | |
| (f+g) M | | |
| g M, g COD | g M, g COD | |
| fase medium | | g M, (f+g) COD |
| (f+g) M, g COD | | |
| fase awal | (f+g) M, (f+g) COD | (f+g) M, (f+g) COD |
| 6-AM, (f+g) M, (f+g) COD | | |
| Fase eliminasi | Setelah intravenus heroin-ilegal | Setelah oral Kodein |
f = bentuk bebas , g = bentuk terikat , M = Morfin, 6-AM = 6-Monoacetylmorfin, COD = Kodein, terdapat kombinasi kualtitatif opiat yang berbeda anatara pemakaian intravenur heroin ilegal dan oral kodein (dicetak miring dan digaris bawahi)
4.2. Menghitung balik waktu paparan terakhir xenobiotika
Seorang toksikolog forensik di negara maju (seperti di Eropa, Amerika atau Australia) dalam memberikan kesaksiannya sebagai saksi ahli dalam kasus toksikologi forensik, biasanya dipersidangan muncul pertanyaan: berapa lama waktu diperlukan sejumlah X xenobiotika yang telah dikonsumsi menjadi “a” konsentrasi di darah pada saat sampling. Pertanyaan ini bukan sembarang pertanyaan yang dengan mudah dapat dijawab, sebab pada umumnya pada kasus toksikologi forensik, jumlah xenobiotika yang dikonsumsi adalah tidak jelas. Jawaban pertanyaan ini mempunyai implikasi hukum yang berbeda, tergantung dengan hukum yang berlaku di negara tersebut.
Pada kasus kedokteran lalu lintas di Eropa, dimana kasus kecelakaan kendaraan bermotor di jalan raya akibat menurunnya kemampuan mengendarai kendaraan dibawah pengaruh efek obat-obatan psikotropika atau narkotika, perkiraan waktu antara kapan obat tersebut di konsumsi sangat mempengaruhi konsekuensi hukum. Apabila berhasil dibuktikan jika obat tersebut dikonsumsi sebelum kecelakaan terjadi dan memang benar konsentrasi yang terdeteksi di darah adalah konsentrasi aktiv farmakologis, hal ini menunjukkan bahwa kemampuan pengendara mengendarai kendaraan bermotor menurun dibawah pengaruh obat, dan oleh sebab perbuatannya itu mengakibatkan kecelakaan lalu lintas yang juga merugikan keselamat orang lain. Hal ini mempunyai implikasi hukum yang berat, karena perbuatannya dapat menyancam keselamatan nyawa orang lain. Kosekuensi hukum menjadi lebih ringan, apabila misal konsentrasi tertentu obat terlarang (contoh morfin) di dalam darah yang diterok tepat beberapa saat setelah kecelakaan terjadi, berhasil dibuktikan bahwa obat tersebut dikonsumsi setelah kecelakaan terjadi dan dengan tujuan alasan medis (analgesik).
Pada umumnya penerokan dilakukan beberapa jam setelah kecelakaan. Agar dapat menduga efek farmakologis toksikan pada saat terjadinya kecelakaan (“t waktu”), maka seorang toksikolog forensik dituntut dapat menghitung kembali konsentrasi xenobiotika pada saa kecelakaan terjadi. Dan menginterpretasikan, apakah konsentrasi toksikan pada saat “t waktu” memberikan efek menurunkan kemampuan mengemudi. Interpretasi ini seharusnya didukung oleh pengamatan psiologis korban di lapangan pada pada saat kejadian, seperti ketenangan berbicara, ukuran pupil, tingkah laku (tenang, gelisah, tegang, dll), dari nafasnya tercium bau aromatis /alkohol.
Betapa sulit menghitung kembali selang waktu ini atau menghitung kembali konsentrasi toksikan pada saat “t waktu”, namun toksikolog forensik berhusaha berdasarkan sifat toksokinetik baik xenobiotika maupun metabolitnya. Dalam hal ini seharusnya memperhatikan semua proses toksokinetik, namun biasanya perhitungan dapat hanya berdasarkan waktu paruh terminal toksikan. Pada umumnya toksikan mengikuti laju kinetik orde ke pertama, maka perubahan konsentrasi dapat dihitung berdasarkan persamaan berikut:
ln (C)t = ln (C)ts + 0,693 / t1/2 (ts - t) (13)
[C]t = konsentrasi pada saat kejadian “t waktu”
[C]ts = konsentrasi pada saat sampling “ts waktu”
t½ = waktu paruh
Pada prakteknya, sering toksikolog forensik mendapatkan sampel yang diterok pada satu titik waktu, dimana jarang disertai informasi penunjang lainnya, seperti dosis awal, kapan waktu awal paparan toksikan, sifat toksikologi individual, serta kelainan patologis maupun psiologis pasien / korban. Oleh sebab itu perhitungan, yang hanya berdasarkan persamaan (13), akan menjadi sangat sulit. Menimbang, bahwa reaksi biotrasformasi dapat dipandang sebagai suatu reaksi rantai (lihat gambar 1), dimana kondisi lingkungan (tubuh) selama terjadinya reaksi biotransformasi adalah indentik. Jika diturunkan rasio antara konsentrasi [m] (metabolit) dan [p] (senyawa induk) maka ratio ini tidak tergantung pada dosis dan ditentukan oleh laju eleminasi toksikan dan metabolitnya. Ratio ini merupakan fungsi waktu dengan membuat kurva-ratio-waktu (lihat gambar 5), berdasarkan tingkat ratio ini dimungkinkan untuk menghitung kembali selang waktu atara waktu awal paparan dan sampling.
Jika pada suatu analisis toksikologi forensik, positiv dideteksi opiat, dengan menurunkan ratio konsentrasi [MG]/[M] dan dengan membandingkan tingkat ratio tersebut terhadap kontrol, maka akan dimungkinkan memperkirakan kapan waktu awal paparan terjadi.
5) Keimpulan
Secara umum pengetahuan farmakokinetik diperlukan untuk menjawab pertanyaan-pertanyaan, seperti: kapan xenobiotika (obat) tersebut digunakan dan berapa banyak obat tersebut telah dikunsumsi. Melalui pengetahuan biotransformasi akan dimungkinkan untuk merunut balik obat apa (parent drug) yang terlah dikonsumsi. Pengetahuan farmakodinamik dapat membantu dalam menjawab pertanyaan-pertanyaan, seperti: apa efek toksik yang ditimbulkan?, berapa lama efek toksik tersebut berlangsung?. Secara sederhana farmakokinetik menjawab pertanyaan perlakuan apa yang diberikan tubuh pada xenobiotika, sedangkan farmakodinamik menjawab pertanyaan kerja apa yang ditimbulkan oleh xenobiotika terhadap tubuh organisme.
6) Datar Pustaka
1. Bogusz, M.J., Maier, R.D., Erkens, M. dan Kohls, U. (2001), ”Detection of non-prescription heroin markers in urine with liquid chromatography-atmospheric pressure chemical ionization mass spectrometry”, J. Anal. Toxicol., 25: 431-438
2. Bourquin, D., Bundeli, P. dan Lehmann, T. (1999), “Diacetylmorphine and its metabolites in plasma by HPLC with diode-array and atmospheric pressure ionization mass spectrometric detection” J. Liq. Chrom. Rel. Technol., 22: 2663-2674.
3. Caraco, Y., Sheller, J. dan Wood, A.J.J. (1999), “Impact of ethnic origin and quinidine coadministration on codeine’s disposition and pharmacodynamic effects”, J. Pharmacol. Exp. Ther., 290: 413-422
4. Ceder, G. dan Jones, A.W., (2001), “Concentration ratios of morphine to codeine in blood of impaired drivers as evidence of heroin use and not medication with codeine”, Clin. Chem., 47: 1980-1984
5. Chen, Z.R., Somogyi, A.A., Reynolds, G. dan Bochner, F. (1991), “Disposition and metabolism of codeine after single and chronic doses in one poor and seven extensive metabolisers”, Br. J. clin. Pharmacol., 31: 381-390
6. Cone, E.J. Welch, P., Mitchell, J.M. dan Paul, B.D. (1991a),”Forensic drug testing for opiates: I. Detection of 6-acetylmorphine in urine as an indicator of recent heroin exposure; drug and assay considerations and detection times” J. Anal. Toxicol. 15: 1-7
7. Gyr, E., Brenneisen, R., Bourquin, D., Lehmann, T.dan Hug,
8. Inturrisi, C.E., Max, M.B., Foley, K.M., Schultz, M., Shin S.-U.dan Houde R.W. (1984), “The pharmacokinetics of heroin in patients with pain”, N. Eng. J. Med., 310: 1213-1217
9. Lockridge, O., Mottershaw_Jackson, N., Eckerson H.W. dan La Du, B.N. (1980), “Hydrolysis of diacetylmophine (Heroin) by human serum cholinesterase”, J. Pharmacol. Exp. Ther., 215: 1-8
10. Mutschler, E.dan Schäfer-Korting, M. (1997), “Arzneimittelwirkungen”, 7. Auflage, Wissenschaftliche Verlagsgesellschaft mbH, Suttgart.
11. O'neal. C.L. dan Poklis, A. (1998), “ The detection of acetylcodeine and 6-acetylmorphine in opiate positive urines”, Forensic. Sci. Int., 95:1-10
12. Osborne, R., Joel, S., Trew, D. dan Slevin, M (1990), “Morphine and metabolite behavior after different routes of morphine administration: demonstration of the importance of the active metabolite morphine-6-glucuronide” Clin. Pharmacol. Ther., 47:12-19
13. Rentsch, K.M., Kullak-Ublick, G.A., Reichel, C., Meier, P.J. dan Fattinger, K. (2001), “Arterial and venous pharmacokinetics of intravenous heroin in subjects who addicted to narcotics”, Clin. Pharmacol. Ther., 70: 237-246
14. Salmon, A., Goren, Z., Avissar, Y.dan Soreq, H. (1999), “Human erythrocyte but not brain acetylcholinesterase hydrolyses heroin to morphine, Clin. Exp. Pharmacol. Physiol., 26: 596-600
15. Schmitt, G., Bogusz, M. Aderjan, R. dan Meyer, C. (1990), “Zum Nachweis von Morphin und Codein in Blutproben mit GC/MS (NCI und PCI) und zur Unterscheidung einer Codeinaufnahme von Heroin- oder Morphinkonsum“, Z. Rechtsmed., 103: 513-521
16. Vree, T.B. dan Verwey-Van Wissen, C.P. (1992), “Pharmacokinetics and metabolism of codeine in humans”, Biopharm. Drug Dispos., 13(6): 445-460
17. Weiss, M. (1990), “Theoretische Pharnakokinetik; Modellierung, Datenanalyse, Dosierungsoptimierung”, Verl. Gesundheit GmbH, Berlin.
18. Weiss, M. (1998),” Analysis of metabolite formation pharmacokinetics after intravenous and oral administration of the parent drug using inverse Laplace-transformation”, Drug Metab. Dispos., 26: 562-565
19. Wirasuta I M.A.G. (2004), Untersuchung zur Metabolisierung und Ausscheidung von Heroin im menschlichen Körper. Ein Beitrag zur Verbesserung der Opiatbefundinterpretation, Cuvillier Verlag, Göttingen.
20. Wirasuta, I M.A.G., (2005), Hambatan dalam pengegakan Undang-Undang No 22 th 1997 tentang Narkotika, khususnya pada penyalahgunaan narkotika golongan opiat ditinjau dari sifat farmakokinetiknya, dalam Wirasuta, I M.A.G., et al. (Ed.) (2005), Peran kedokteran forensik dalam penegakan hukum di Indonesia. Tantangan dan tuntuan di masa depan, Penerbit Udayana, Denpasar
21. Wirasuta, I M.A.G., Thoben, M., Duchstein H-J., Saternus, K.S. dan Kijewski, H. (2002), “Möglichkeiten und Grenzen der rechnerischen Simulation der Pharmakokinetik des Heroins im menschlichen Körper“, (Abstract), Rechtsmedizin, 12: 274
22. Wirasuta, I M.A.G., Thoben, M., Duchstein, H.-J. dan Kijewski H. (2003), “Rechnerische Simulation der Pharmakokinetik der Opiate im menschlichen Körper zur Unterscheidung einer Codeinaufnahme von einem Straßenheroinkonsum“, (Abstract), Rechtsmedizin, 13: 242
23. Yeh, S.Y., Gorodetzky, C.W. aan Krebs, H.A., (1977), Isolation and identification of morphine-3-and -6- glucuronides, morphine-3,6-diglucuronide, morphine-3-ethereal sulfate, normorphine, and normorphine-6-glucuronide as morphne metabolites in human., J. Pharm. Sci., 66: 1288-1293
Tidak ada komentar:
Posting Komentar